Quo Vadis SOP – Thesen zur digitalen Transformation im SOP- und Trainingsmanagement
Produkte aus dem GMP-regulierten Umfeld und ihre Fertigung unterliegen hohen Anforderungen an die Qualität. Mit GMP – Good Manufacturing Practice – werden Qualitätssicherungsvorgaben zusammengefasst, die sich aus nationalen und internationalen Regelwerken ergeben, also aus Gesetzen, Normen, Verordnungen, Standards etc., die bei der Produktion berücksichtigt werden müssen.
Mittlerweile hat die digitale Transformation auch das GMP-Umfeld erfasst. Die fortschreitende Digitalisierung von Produktionsprozessen in Unternehmen geht einher mit einer zunehmenden Verbreitung von IT-Systemen, die im unternehmensinternen Qualitäts- und Compliance-Management eingesetzt werden. Dabei sind die Ansätze für Digitalisierung vielfältig: Sie reichend von GMP-relevanten Dokumenten (insbes. SOPs), ihren Formaten und ihrer redaktionellen Erstellung, über den gesamten regulatorisch konformen Managementprozess bis hin zur Verteilung GMP-relevanter Dokumente an diejenigen Mitarbeiter, die über die Inhalte unterrichtet sein müssen.
Der Grad der Digitalisierung von GMP-relevanten Prozessen im Qualitäts- und Compliance-Management variiert noch erheblich. Diese Feststellung trifft auf den Umfang der IT-Unterstützung ebenso zu wie auf die Zahl der verwandten IT-Systeme und den Grad ihrer Integration. Von einiger Relevanz sind auch innovative Ansätze zur arbeitsplatzintegrierten Unterweisung auf Basis neuer Technologien zur Wissensvermittlung.
So vielfältig die Ansätze zur Digitalisierung sind – jeder Beitrag zur Innovation steht letztlich unter dem Vorbehalt der Zustimmung durch die regulierenden Organisationen. Immer besteht die latente Gefahr, dass selbst eine sanfte Disruption die schon etablierten Verfahren negativ beeinflussen könnte. Allerdings darf – bei aller gebotenen Vorsicht – nicht übersehen werden, dass die Regulierungsbehörden selbst die Möglichkeiten der Digitalisierung durchaus wohlwollend betrachten und deren Umsetzung dann auch zeitnah erwarten.
Die nachfolgenden Thesen skizzieren Leitlinien für die digitale Transformation im GMP-konformen Qualitäts- und Compliance-Management. Sie zeigen Perspektiven für eine mögliche Neuorientierung auf und vermitteln Denkanstöße, die hoffentlich unangenehmen „Überraschungen“ vorbeugen helfen.
1. GMP-Regulierungen betreffen zentrale Branchen der deutschen Wirtschaft; sie gelten auch und in einem besonderen Maße für kleine und mittelständische Betriebe
GMP-regulierte Branchen sind in Deutschland von einiger wirtschaftlicher Bedeutung:
- Die pharmazeutische Industrie erzielt mit rund 110.000 Mitarbeitern einen Umsatz von 36,2 Mrd. Euro (2014). Bemerkenswert dabei ist, dass es sich bei 90% der Betriebe um mittelständische Unternehmen mit weniger als 500 Mitarbeitern handelt; nur 7,3% der Pharmaunternehmen hatten 2012 mehr als 500 Mitarbeiter.[1]
- In der Medizintechnik erwirtschaften ca. 1.230 Betriebe mit insgesamt 130.500 Mitarbeitern einen Umsatz von 27,6 Mrd. Euro (2015).[2] Sowohl Umsatz als auch Mitarbeiterzahl weisen in den letzten 10 Jahren starke, überdurchschnittliche Zuwächse auf.[3] Auch hier zeigt die Unternehmensstruktur einen hohen Anteil mittelständischer Betriebe: 95 Prozent der Medizintechnik-Unternehmen beschäftigen weniger als 250 Mitarbeiter.[4] Wie die Pharmaindustrie zeichnet sich die Medizintechnik durch hohe Forschungsintensität und eine hohe Innovationsrate aus.
- In der kommerziellen Biotechnologie in Deutschland arbeiten etwa 33.870 Menschen, überwiegend in kleinen Unternehmen: Nahezu jede zweite Firma (43,5 %) zählt weniger als zehn Mitarbeiter; 43,7 % haben zwischen zehn und fünfzig Mitarbeiter; nur 30 Unternehmen beschäftigen mehr als einhundert Mitarbeiter.[5] Der erzielte Umsatz lag 2015 bei 3,28 Mrd. Euro.[6]
- Die Lebensmittelindustrie erzielte 2015 einen Umsatz von 172,18 Mrd. Euro. Die Anzahl der Betriebe beläuft sich auf etwa 5.900 mit einer Gesamtzahl von ca. 554.000 Beschäftigten.[7]
- Die chemische Industrie, beschäftigt in Deutschland 438.000 Mitarbeiter, die einen Umsatz von 150 Mrd. Euro erwirtschaften (2013).[8] Rund 2.000 Unternehmen gehören in Deutschland zur chemischen Industrie, davon sind mehr als 90 Prozent kleine und mittlere Unternehmen.[9] Der Umsatz der Kosmetikindustrie, die als Sub-Branche der chemischen Industrie GMP-relevant ist, lag 2015 bei ca. 6,2 Mrd. Euro.[10]
Die hohe GMP-Regulierungsdichte in klein- und mittelständisch geprägten Branchen führt bisweilen zu Überforderung; GMP-Anforderungen werden häufig zur Last.
2. Konformität mit GMP-Regularien ist für Unternehmen im regulierten Umfeld von zentraler Bedeutung
GMP-Regulierungen setzen hohe Maßstäbe für die Qualitätssicherung. Strenge Vorgaben ergeben sich z.B. aus Normen wie ISO 9001 (Qualitätsmanagementsystem), ISO 13485 (Managementsystem für das Design und die Herstellung von Medizinprodukten); GMP-Vorgaben entstehen auch aus Regulierungen wie dem 21 Code of Federal Regulations Part 210 und 211[11] der US-amerikanischen Food and Drug Administration (FDA) bzw. aus entsprechendem Regulierungen in der EU GMP Guideline[12] auf europäischer Ebene.
GMP-Regulierungen müssen in der Fertigung berücksichtigt werden. Hiervon hängt die Zulassung als Produzent bzw. die Zulassung von einzelnen Produkten ab. Nicht-Konformität kann zu enormen wirtschaftlichen Schäden führen, etwa durch Produktionsstopp, veranlasst durch Regulierungsbehörden wie der FDA, oder durch Rückrufaktionen wegen mangelnder Produktqualität: Für 2016 listet das Bundesinstitut für Arzneimittel und Medizinprodukte bis dato (Oktober 2016) bereits 237 Rückrufaktionen aufgrund von Qualitätsmängeln, die in Produkten festgestellt wurden.[13] Ein dramatisches Beispiel für die Konsequenzen, die sich aus GMP-Verstößen ergeben, ist das US-amerikanische Bluttest-Unternehmen Theranos:[14] Zunächst wurde die Produktinnovation und die Gründerin von Investoren und der Finanzpresse als nächstes Unicorn hochgejubelt, um dann wegen mangelnder Produktqualität wieder auf eine Unternehmensbewertung nahe Null abzufallen.
3. Industrie 4.0 erhöht die Komplexität für GMP-Regularien
Die Komplexität der Anforderungen an das GMP-konforme Qualitätsmanagement steigt mit dem Übergang zu „Industrie 4.0“ weiter an (Stichwort „Qualität 4.0“). Wesentlich dabei ist die notwendige enge Verzahnung von Qualitätssicherung und Produktion und ihre integrierte Steuerung durch ein Produktionsleitsystem oder Manufacturing Execution System (MES); die Möglichkeit zur wirtschaftlichen Herstellung von Kleinserien und selbst von Losgröße 1 vervielfacht zusätzlich den Aufwand im Qualitätsmanagement: Für Losgröße 1 gelten dieselben Anforderungen an die Herstellerdokumentation und dieselben GMP-relevanten Vorgaben wie für Großserien in der Produktion. Dies erfordert neue Ansätze zur Reduktion von Aufwand und Komplexität.
4. Qualität 4.0 braucht SOP 4.0
Ein zentrales Instrument der Qualitätssicherung und des Compliance Managements in der prozessorientierten Fertigung im GMP-regulierten Umfeld sind Standard Operating Procedures (SOPs). SOPs sind Dokumente mit anweisendem Charakter. Sie enthalten verbindliche, detaillierte Beschreibungen von betrieblichen Abläufen und Prozessen in kritischen Bereichen von Entwicklung und Produktion. Sie kommen dort zur Anwendung, wo potenzielle Auswirkungen auf Sicherheit, Gesundheit oder Umwelt zu erwarten sind; und sie sind ein wichtiges Instrument zur Einhaltung der „regulatory Compliance“, also zur strikten Beachtung geltender Gesetze, Normen, Standards, Richtlinien etc. in der Produktion.
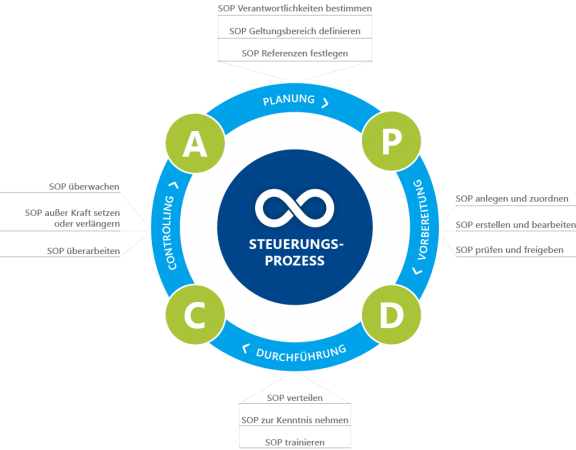
Die einzelnen Schritte innerhalb des innerbetrieblichen SOP-Managementprozesses lassen sich als PDCA-Zyklus (Plan-Do-Check-Act) wie folgt darstellen:
Abbildung 1: PDCA-Zyklus SOP-Management
Eine SOP ist das Bindeglied zwischen Produktionsinfrastruktur mit Arbeitsplatz- und Tätigkeitsbeschreibung auf der einen und der „Ressource“ Mensch auf der anderen Seite. Ohne Kenntnis der SOP, ohne Training und ohne Trainingsnachweis darf die Person nicht tätig werden. Allerdings hat dieses System auch seine Lücken: Wer weiß, ob die SOP nicht nur gelesen, sondern tatsächlich auch verstanden wurde? Und wer verhindert, dass eine Tätigkeit mangels Alternativen doch ausgeführt wird, obwohl der Trainingsnachweis überhaupt nicht vorhanden ist?
Im Kontext von Industrie 4.0 wird sich dies ändern: Die SOP übernimmt selbst die Zugangssteuerung. Denn das Qualifikationsprofil eines Mitarbeiters für den Geltungsbereich einer SOP ist mit dieser verknüpft; es ist also bekannt und dokumentiert. Damit steuert die SOP die Zugangs- und Bearbeitungsberechtigung und übernimmt so die Metasteuerung über den Produktionsprozess.
5. Digitalisierung ist der Schlüssel zu mehr Effizienz und Qualität im SOP- und Trainingsmanagement
Selbst in mittelständischen Unternehmen beläuft sich die Anzahl von SOPs und der dazugehörenden „mitgeltenden Dokumente“, die dem regulatorisch konformem Management unterliegen, rasch auf mehrere Tausend. Erfahrungswerte aus dem Pharma-Umfeld zeigen, dass in Betrieben mit ca. 500 Mitarbeitern etwa 1.000-2.000 SOPs Anwendung finden; Unternehmen mit bis zu 5.000 Mitarbeitern verwalten etwa 20.000-30.000 SOPs; und bei Herstellern mit mehr als 10.000 Mitarbeitern sind es schnell weit über 200.000 SOPs mit GMP-Relevanz.[15]
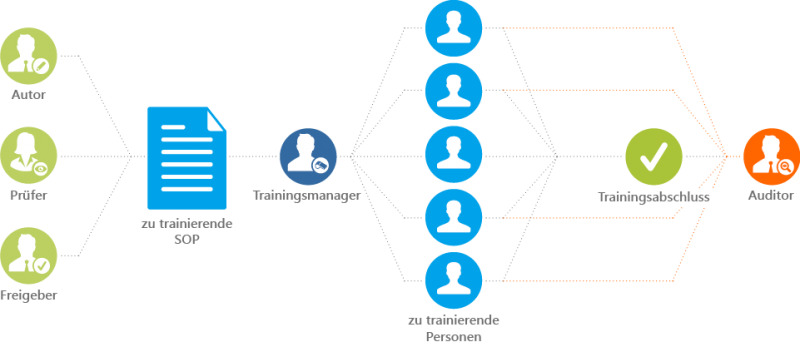
Ein vereinfachter SOP-Workflow ist nachfolgend dargestellt. Dieser veranschaulicht die beteiligten Akteure und den Handlungsbedarf:
Abbildung 2: Vereinfachter SOP Workflow
Wie aufwändig das SOP-Management sein kann, zeigt beispielhaft der Teilprozess „Leseverständnis“, der aus mehreren Einzelschritten besteht: SOPs werden in gedruckter Form Mitarbeitern zur Kenntnisnahme zugestellt; SOPs werden gelesen, vom Mitarbeiter dann unterzeichnet, wieder eingesammelt und dann abgelegt. Legt man das dargestellte Mengengerüst zugrunde und multipliziert die Anzahl der Mitarbeiter mit Anzahl der zu administrierenden SOPs, dann wird schnell deutlich: Die administrativen Aufwände können mit einer konventionellen, d.h. papierbasierten Dokumentenlenkung nicht mehr bewältig werden.
In der Digitalisierung von Prozessen und Dokumenten liegt dagegen ein enormes Potenzial für mehr Effizienz und Sicherheit im Management von SOPs – und für mehr Qualität in qualitätssichernden Maßnahmen durch SOPs.
Allerdings wird dieses Potenzial in der Praxis noch längst nicht genutzt; sehr unterschiedliche Reifegrade der Digitalisierung von SOP-Prozessen sind zu erkennen. Die Reifegradanalyse zeigt folgende Stufen der Digitalisierung:
Stufe 1 – keine Digitalisierung: Die SOP-Erstellung erfolgt weitestgehend auf Basis von Office-Anwendungen. Der gesamte Managementprozess der Dokumentenlenkung und dessen Dokumentation erfolgt papierbasiert und manuell. Das Management der durch SOPs induzierten Trainingsprozesse, wie zum Beispiel die Aufforderung von Mitarbeitern zur Teilnahme an Präsenzschulungen, und die Dokumentation der Trainingsnachweise erfolgen ebenfalls weitestgehend manuell und ohne IT-Unterstützung.
Stufe 2 – Digitalisierung in hybrider Systemlandschaft: In der nächsten Ausbaustufe werden die Dokumentenlenkung und das Trainingsmanagement durch verschiedene IT-Systeme unterstützt, die ggf. über Schnittstellen verbunden werden.
Stufe 3 – Integriertes SOP-und Trainingsmanagement: Die SOP-Dokumentenlenkung und das Trainingsmanagement sind einem integrierten Managementsystem abgebildet. Lediglich die SOP-Erstellung erfolgt extern, z.B. auf Basis von Office-Anwendungen.
Stufe 4 – Durchgehende Digitalisierung: Das SOP- und Trainingsmanagement ist ein homogener, durchgehend digitalisierter Lebenszyklus in einem integrierten Managementsystem; alle Phasen im SOP- und Trainingsmanagement sind digitalisiert und laufen ohne Medienbrüche in einer digitalen Managementumgebung ab.
6. Alle SOP-Prozesse (Erstellung, Lenkung, Anwendung) werden zunehmend digitalisiert
Schwerpunkt der Digitalisierung im SOP-Management ist die weitgehende Automatisierung der Lenkung von Dokumenten. Automatisierte Workflows sowie Reminder- und Eskalationsmechanismen für einzelne Prozessschritte reduzieren den administrativen Aufwand signifikant. Verantwortliche im Management von SOPs werden so von Routineaufgaben entlastet. Automatisierte Regelwerke müssen dafür definiert, formalisiert und in einem Managementsystem implementiert werden.
Digitalisierung erhöht aber auch die Transparenz im Management von SOPs: In einer durchgehend digitalisierten Managementumgebung ist der Status einzelner Prozessschritte immer sichtbar; kritische Entwicklungen in den Prozessen werden unmittelbar erkannt; und erzielte Ergebnisse sind detailliert und schnell nachvollziehbar. Aussagekräftige Managementleitstände und leistungsfähige Analysetools werden dafür gebraucht.
7. Bisher rein textbasierte SOPs werden um multimediale, VR-basierte Assets und Trainingsinhalte erweitert
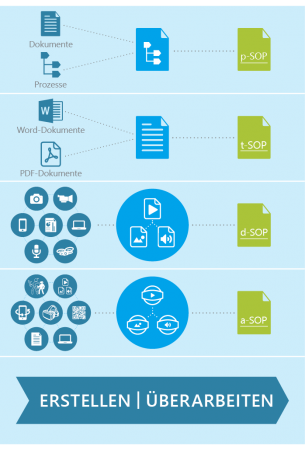
Auch die Form und das Format sowie der gesamte Erstellungsprozess von SOPs werden einer spürbaren digitalen Transformation unterliegen: Aktuell überwiegend text- und dokumentenbasierte SOPs (t-SOP) werden mittelfristig von einem digitalen und zunehmend multimedial angereicherten SOP-Typ (d-SOP) abgelöst werden. Multimedia-Elemente können Bilder, Grafiken, (interaktive) Prozessdiagramme, Audios und Videos sowie „Virtual Reality (VR)“- und „Augmented Reality (AR)“-Komponenten sein. Oftmals dienen auch Prozessanweisungen (p-SOP) als Orientierungsrahmen zur Erstellung von SOPs, wobei Prozessmodelle dann in die textuellen Ausführungen integriert werden.
Das übergreifende Anliegen beim Übergang von t-SOPs zu d-SOPs ist auch hier, die Qualität der Anweisungen zu verbessern, dadurch Qualität und Sicherheit in der Produktion zu stärken und damit letztlich Produktionsrisiken und damit zusammenhängende Kosten zu vermeiden. Dass Multimedia-Elemente dazu beitragen können und dass multimedial aufbereitete, digitale SOPs an Bedeutung zunehmen, wird durch folgende Beobachtungen bestätigt:
- Multimediale Assets tragen zur Veranschaulichung komplexer Sachverhalte bei und fördern dadurch das Verständnis auf Seiten derer, die mit der Durchführung von Abläufen betraut sind;
- Multimedial aufbereitetes Material erreicht Zielgruppen effektiv, die mit dem Lesen von sehr technischen Texten – und um solche handelt es sich bei SOPs durchaus – überfordert sind;
- Authentisches multimediales Material (Fotos, Video-Clips) kann mittlerweile kostengünstig, unaufwändig, ohne signifikante Eingriffe in betriebliche Prozesse – und damit quasi mikroinvasiv – erstellt werden;
- Vergleichbares gilt für Nutzung multimedialer Dokumente; die dafür erforderliche Technologie (Hard- und Software) ist mittlerweile ubiquitär und kostenneutral bzw. zu überschaubaren Kosten verfügbar und kann niederschwellig genutzt werden.
Abbildung 3: Erweiterung der SOP-Formate
8. SOPs mit „Augmented Reality“ werden die Wissensvermittlung am Arbeitsplatz unterstützen
„Augmented Reality“ (AR) bietet vielfältige Möglichkeiten, SOP-Anweisungen direkt mit Produktionsprozessen zu verknüpfen (a-SOP): Anweisungen aus einer SOP werden visualisiert und als digitale Zusatzinformation in einem AR-fähigen Zusatzgerät (z.B. Microsoft HoloLens, Google Cardboard, HTC One) durch Einblendung bzw. Überlagerung direkt mit der Realitätswahrnehmung eines Mitarbeiters kombiniert. So bieten sie eine direkte Unterstützung am Arbeitsplatz und integrieren sich stärker in Arbeits- und Produktionsprozesse; die neue Generation von d-SOPs und a-SOPs steht damit in einem engen Zusammenhang mit dem Wandel, der sich unter dem Stichwort „Industrie 4.0“ vollzieht. Anweisung (SOP) und Umsetzung rücken somit enger zusammen.
Hard- und Software (360o-Kamera, VR-Brille, Apps etc.) für die Produktion und Nutzung von AR-Elementen sind mittlerweile einfach und kostengünstig zu beschaffen; bereits vorhandene Geräte (Smartphones, Tablets) können schnell um AR-Fähigkeit erweitert und direkt eingesetzt werden. Die Konsequenz aus diesem Digitalisierungsschritt ist deutlich: Integrierte Autoren- und Redaktionsumgebungen für d- und a-SOPs ergänzen die bisher bekannten Verfahren der Erstellung von SOPs.
9. Das Leseverstehen von SOPs wird durch interaktive Lernerfolgskontrollen ergänzt
Neue Anforderungen im Rahmen des SOP-Managements in GMP-regulierten Unternehmen werden aktuell an das Training von SOPs gestellt: Externe Regulierungsorganisationen fordern zunehmend eine detailliertere Dokumentation der Trainingsprozesse und -ergebnisse, also Nachweise über den Verlauf und die Ergebnisse von Schulungen für Mitarbeiter über Inhalte von SOPs.
Bislang reichten für die Mitarbeiterschulung dokumentierte Lesebestätigungen aus: Eine SOP wird den betreffenden Mitarbeitern zugestellt; sie bestätigen Empfang und Lektüre des Dokuments. Neuerdings richtet sich das Interesse aber verstärkt auf die Ermittlung, Analyse und Dokumentation des Trainingserfolgs: An die Stelle einfacher Lesebestätigungen treten differenziertere Abschlusstests, die das Verständnis von SOP-Inhalten durch Testfragen und –aufgaben unterschiedlichen Typs und in Kombination mit multimedialen Elementen (Bilder, Grafiken, Video-Clips etc.) ermitteln.
Auch diese Entwicklung stärkt letztlich die Sicherung von Qualität: Erzielte Trainingsergebnisse und der tatsächlich im Unternehmen erreichte Wissensstand werden dokumentiert; Trainingsprozesse werden zudem transparenter und dadurch besser steuerbar. Diese Integration von interaktiven Lernerfolgskontrollen und digitalen Lerninhalten finalisieren den SOP Closed Loop-Prozess als weiteren Schritt einer digitalen Optimierung.
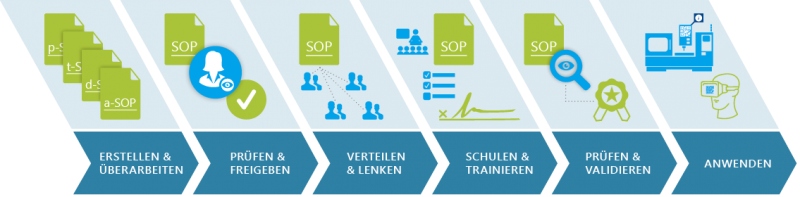
10. Der SOP Life Cycle wird in Zukunft durch Cloud-basierte Assistenzsysteme und Services unterstützt
Qualitätsmanagement- und Compliance-Prozesse für das SOP- und Trainingsmanagement werden künftig vollständig IT-technisch unterstützt. Die digitale Transformation erfasst also alle Phasen des regulatorisch konformen Managements von Qualität.
Abbildung 4: SOP-Life Cycle
Ein tiefgreifender Wandel vollzieht sich aber auch bei den IT-Systemen selbst, bei ihrer Bereitstellung und Nutzung. Noch werden technische Lösungen im regulierten Umfeld vorwiegend als „on premise“-Lösungen realisiert: Managementsysteme werden in der unternehmensinternen IT-Infrastruktur installiert und von den eigenen IT-Spezialisten administriert. Allerdings liegen mittlerweile auch positive Anwendungserfahrungen mit solchen Systemen vor, die als Cloud-Dienste das gesamte Anwendungsspektrum abdecken:[16] Softwaresysteme werden in diesem Modell in einem externen Rechenzentrum und von einem beauftragen Dienstleister betrieben; im Unternehmen selbst wird die Software über gesicherte Zugriffe genutzt. Die fachliche Administration durchgängig digitalisierter SOP- und Trainingsmanagementprozesse verbleibt im Unternehmen.
Diese Entkopplung von technischem Betrieb und fachlicher Nutzung von IT-Systemen kann von erheblichem Vorteil sein: Sie bietet Verlässlichkeit im Betrieb bei tendenziell geringeren Kosten. Aber eines ist klar: Die Sicherheit muss stimmen.
Über Cloud-Lösungen eröffnen sich zudem vielfältige Möglichkeiten, digitalisierte Managementprozess bei SOPs und Training durch zusätzliche Mehrwertdienste zu erweitern: Intelligente Assistenzservices mit Frühwarnfunktionen bei kritischen Ereignissen können ergänzt werden; Feedbackfunktionen helfen, die erstellten SOPs in einem kontinuierlichen Prozess weiter zu verbessern. Cloud-Dienste können auch die Produktion multimedialer Assets genutzt werden, die dann in d-SOPs und a-SOPs Eingang finden. Mit dieser Entwicklung gewinnen dann auch digitale und arbeitsplatznahe Bildungsstrategien in GMP-regulierten Unternehmen an Bedeutung.
Anmerkungen
[1] https://www.pharma-fakten.de/die-branche/ (zuletzt abgerufen am 13.10.2016)
[2] http://www.spectaris.de/uploads/tx_ewscontent_pi1/Jahreszahlen_2015_web2_04.pdf (zuletzt abgerufen am 13.10.2016)
[3] https://de.statista.com/themen/793/medizintechnik/ (zuletzt abgerufen am 13.10.2016)
[4] https://www.bvmed.de/download/bvmed-branchenbericht-medtech (zuletzt abgerufen am 14.10.2016)
[5] https://www.biotechnologie.de/BIO/Navigation/DE/Hintergrund/studien-statistiken,did=151488.html?view=renderPrint (zuletzt abgerufen am 14.10.2016)
[6] https://www.biotechnologie.de/BIO/Navigation/DE/Hintergrund/studien-statistiken,did=186898.html?listBlId=74636& (zuletzt abgerufen am 14.10.2016)
[7] https://de.statista.com/statistik/faktenbuch/27/a/branche-industrie-markt/lebensmittelindustrie/lebensmittelindustrie/ (zuletzt abgerufen am 17.10.2016).
[8] https://de.statista.com/statistik/faktenbuch/22/a/branche-industrie-markt/chemieindustrie/chemieindustrie/ (zuletzt abgerufen am 14.10.2016).
[9] https://www.vci.de/vci/downloads-vci/publikation/chemische-industrie-auf-einen-blick.pdf (zuletzt abgerufen am 14.10.2016).
[10] https://de.statista.com/themen/25/kosmetik/ (zuletzt abgerufen am 14.10.2016).
[11] Auch genannt 21 CFR 210/211; Herstellungs- und Verpackungsprozess von Arznei- und Lebensmitteln; Regularien für fertige Pharmaprodukte.
[12] EudraLex Vol. 4 Guidelines für good manufacturing practices for medicinal products for human and veterinary use.
[13] http://www.bfarm.de/SiteGlobals/Forms/Suche/Servicefunktionsuche_Formular.html?input_=3494902&resourceId=3496612&submit.x=0&submit.y=0&templateQueryString=R%C3%BCckruf+2016&pageLocale=de (zuletzt abgerufen am 13.10.2016).
[14] https://en.wikipedia.org/wiki/Theranos (zuletzt abgerufen am 13.10.2016).
[15] Quelle: Eigene Erfahrungswerte.
[16] http://www.dhc-vision.com/blog/aenova-group-setzt-im-sop-training-und-capa-management-auf-dhc-vision/ (zuletzt abgerufen am 17.10.2016).

am 02.11.2016 von
Mandy Aatz



In vielen Bereichen ist die Digitalisierung nicht mehr aufzuhalten, so auch im Qualitätsmanagement. Aus diesem Grund erläutern Dr. Tilman Küchler und Dr. Wolfgang Kraemer in diesem Artikel die aktuellen Thesen zur digitalen Transformation im SOP- und Trainingsmanagement.